Epothilone
Die Epothilone sind Polyketide, welche 1987 aus Myxobakterien (Sorangium cellulosum) isoliert worden sind. Sie sind damit keine pflanzlichen Naturstoffe, sind jedoch ein gutes Beispiel für die Entwicklung von Medikamten aus Naturstoffen. Nach der Isolierung der Epothilone stellte sich eine Wirkung auf Brust- und Darmkrebskolonien heraus, die zur näheren Untersuchung des Naturstoffes durch Pharmaunternehmen führte. Schwierig bei der Wirkstoffentwicklung ist dabei die hochkomplexe Struktur der Epothilone, die eine Totalsynthese erschweren, bei gleichzeitiger geringer Verfügbarkeit des Naturstoffes aus natürlichen Quellen. Neben der Pharmaindustrie, die im geheimen an der Totalsynthese arbeiteten, gelang es der Forscher*innengruppe um Nicolaou 1997 die Totalsynthese von Epothilon A und B zu veröffentlichen.
Insbesondere zur Wirkstoffderivatisierung ist die Totalsynthese von zentraler Bedeutung. Erst durch die Möglichkeit der Anpassung der Struktur, ist es möglich den Wirkstoff zu optimieren. Bei Epothilone ist auf Grund der vielen Syntheseschritten die Ausbeute gering, konnte jedoch inzwischen auf ~14 % gesteigert werden.
Die Entwicklung von Medikamenten aus Epothilonderivaten ist in Europa heute noch nicht abgeschlossen, ist jedoch beim Vergleich zu Paclitaxel – ein Naturstoff aus der pazifischen Eibe und schon heute ein Krebsmedikament – vielversprechend. Entgültige klinische Untersuchungen müssen jedoch diese Wirksamkeit erst noch beweisen und Nebenwirkungen ausschließen.
Wirkung
Die Wirkung basiert auf den stabilisierenden Effekt auf Mikrotubuli. Diese sind Bestandteile zur Aufrechterhaltung der Zellarchitektur. Bei der Stabilisierung dieser Filamente wird die Zellteilung gehemmt, was das Krebswachstum behindert. Jedoch wird im Zusammenhang mit Epothilonen auch von einer nervenschädigenden Wirkung gesprochen, die in Europa zur Ablehnung eines aus den USA stammenden Wirkstoffs auf Epothilonbasis führte.
Totalsynthese Epothilon A
Die vorgestellte Synthese ist von der Arbeitsgruppe um K.C. Nicolaou erarbeitet worden. Diese ist im Journal of the American Chemical Society veröffentlicht worden (siehe Literatur).
Die Synthesestrategie der Arbeitsgruppe von Nicolaou et al. geht von drei Verbindungen aus, die spät in der Synthese zu Epothilon A zusammen gebaut werden. Insgesamt werden 7 Stereozentren aufgebaut.
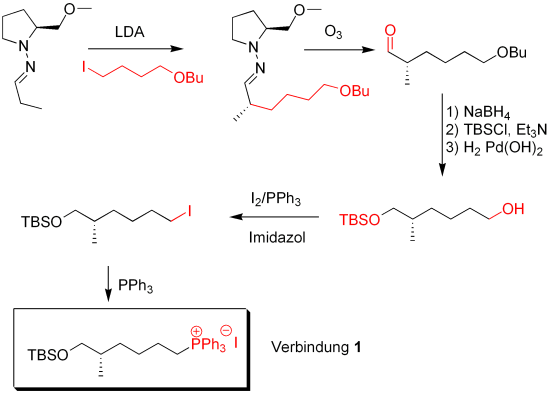
Im ersten Schritt wird die Endersreagenz zum Aufbau des ersten Stereozentrums benutzt. Dieses Auxiliar bildet mit Propanaldehyd die abgebildete Startreagenz, ein sogenanntes Hydrazon. Dieses wird in alpha Position von der Base LDA deprotoniert. So greift die Startreagenz das Butanderivat an. Das Stereozentrum wird enantioselektiv durch die Komplexierung des LDAs mit der Endersreagenz gebildet.
Im zweiten Schritt wird das Endersreagenz abgespalten. Atomökonomisch ist das problematisch, da nahezu das halbe Molekül abgespalten und weggeworfen wird. Die Erzeugung des Stereozentrums ist auf anderen Wege jedoch genauso problematisch.
Anschließend wird der Aldehyd mit NaBH4 zum Alkohol reduziert und mit Tertbutyldimethylsilylchlord (TBSCl) geschützt. Dann wird die Butylschutzgruppe mit H2 und katalytisch Pd(OH)2 abgespalten.
In einer Apelreaktion wird die Alkoholgruppe durch eine Iodidgruppe ersetzt. Anschließend wird mit PPh3 das Phosphorylid gebildet. Verbindung 1 wird später gebraucht.
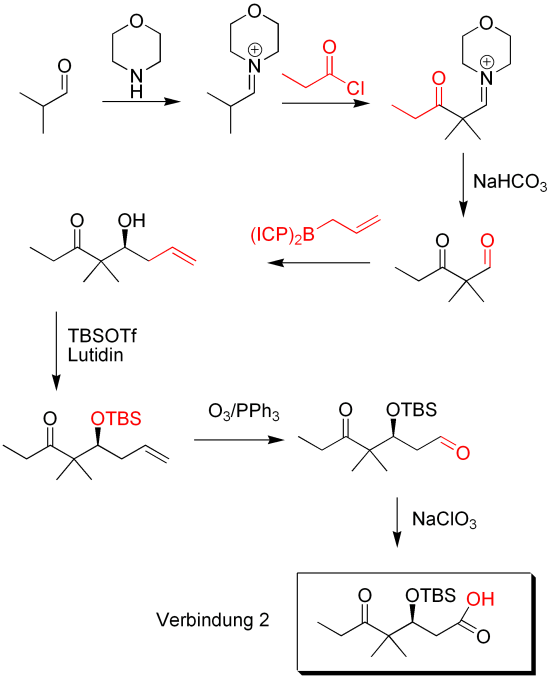
Verbindung 2 wird synthetisiert ausgehend von Isobutanal und Morpholin. In einer Enaminsynthese wird das Propansäurechlorid addiert. Mit NaHCO3 wird der Aldehyd zurückgewonnen. Allylboran greift das Aldehyd an und man erhält stereoselektiv das Produkt. Das gelingt durch die (+)-ICP Liganden, welche Stereoinformation übertragen. Nach anschließender TBS-Schützung wird die terminale Doppelbindung durch Ozonolyse in das Aldehyd überführt. Durch weitere Oxidation erhält man Verbindung 2.
Das käuflich zu erwerbende Edukt, ein Heterozyklus, wird im ersten Schritt zum Aldehyd mittels DIBALH reduziert. In einer Wittigreaktion wird stereoselektiv das Transprodukt gewonnen. Wie im vorhergehenden Schema wird der Aldehyd mit Allylboran umgesetzt und der entstandene Alkohol TBS geschützt. Anschließende Ozonolyse führt zur gewünschten Verbindung 3.
Verbindung 1 und 3 werden nun in einer Wittigreaktion umgesetzt und man erhält stereoselektiv das Cisprodukt. Die terminale TBS Schutzgruppe wird mit Camphersulfonoxid (CSA) abgespalten. Aus sterischen Gründen wird nur die primäre Alkoholgruppe entschützt. Die Oxidation mit SO3 und Pyridin liefert das Aldehyd. Dieses wird als Carbonylgruppe in einer Aldolreaktion mit Verbindung 2 umgesetzt. Bei dieser Reaktion wurde ein Racemat erhalten. Eine spätere Aufarbeitung der Enantiomere ist also nötig. Die entstandene Alkoholgruppe wurde mit TBS geschützt.

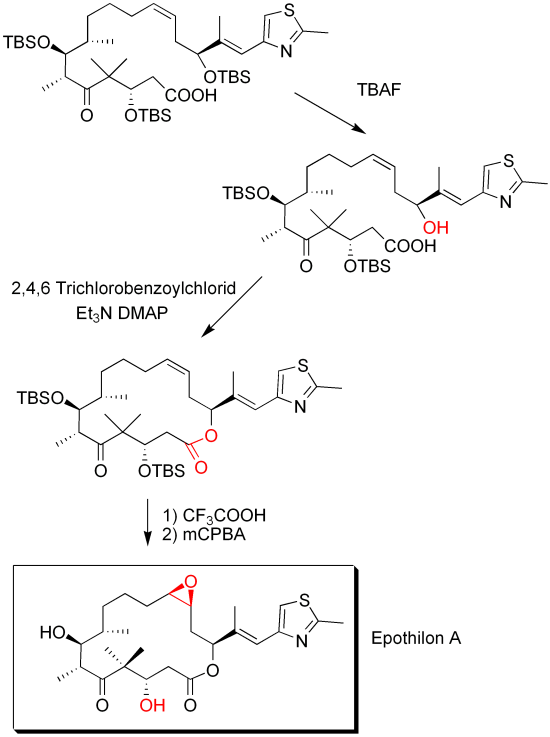
Der letzte Schritt (und nicht selten auch der Schritt der die ganze Totalsynthese zu Fall bringt) ist die Cyclisierung der Verbindung zum Macrozyklus (einem Lacton). Bei dieser Yamaguchiveresterung wird die Carbonsäure durch die Bildung eines Anhydrides aktiviert. Dieses wird von der Alkoholgruppe intramolekular angegriffen und es bildet sich das Lacton (der zyklische Ester). Im vorletzten Schritt wurden alle Schutzgruppen entfernt. Mit meta-Chlorperbenzsäure (mCPBA) wurde schlußendlich das Epoxid gebildet.
Nicolaou beschreibt in seiner Veröffentlichung ebenfalls die Synthese von Epothilon B, welche nahezu identisch ist.