Pinene
Pinene sind dicyclische Monoterpene der Strukturformel C10H16. Sie sind Bestandteil in den ätherischen Ölen des Rosmarins oder des Terpentinöls. Derzeit sind sechs verschiedene Pinene bekannt die sich in drei Enantiomerenpaare einteilen lassen.
Pinene können als Vorstufe von wichtigen Riechstoffen der Kosmetikindustrie verwendet werden. In der chemischen Forschung werden Pinene als chirale Liganden eingesetzt.
Eigenschaften
Biosynthese
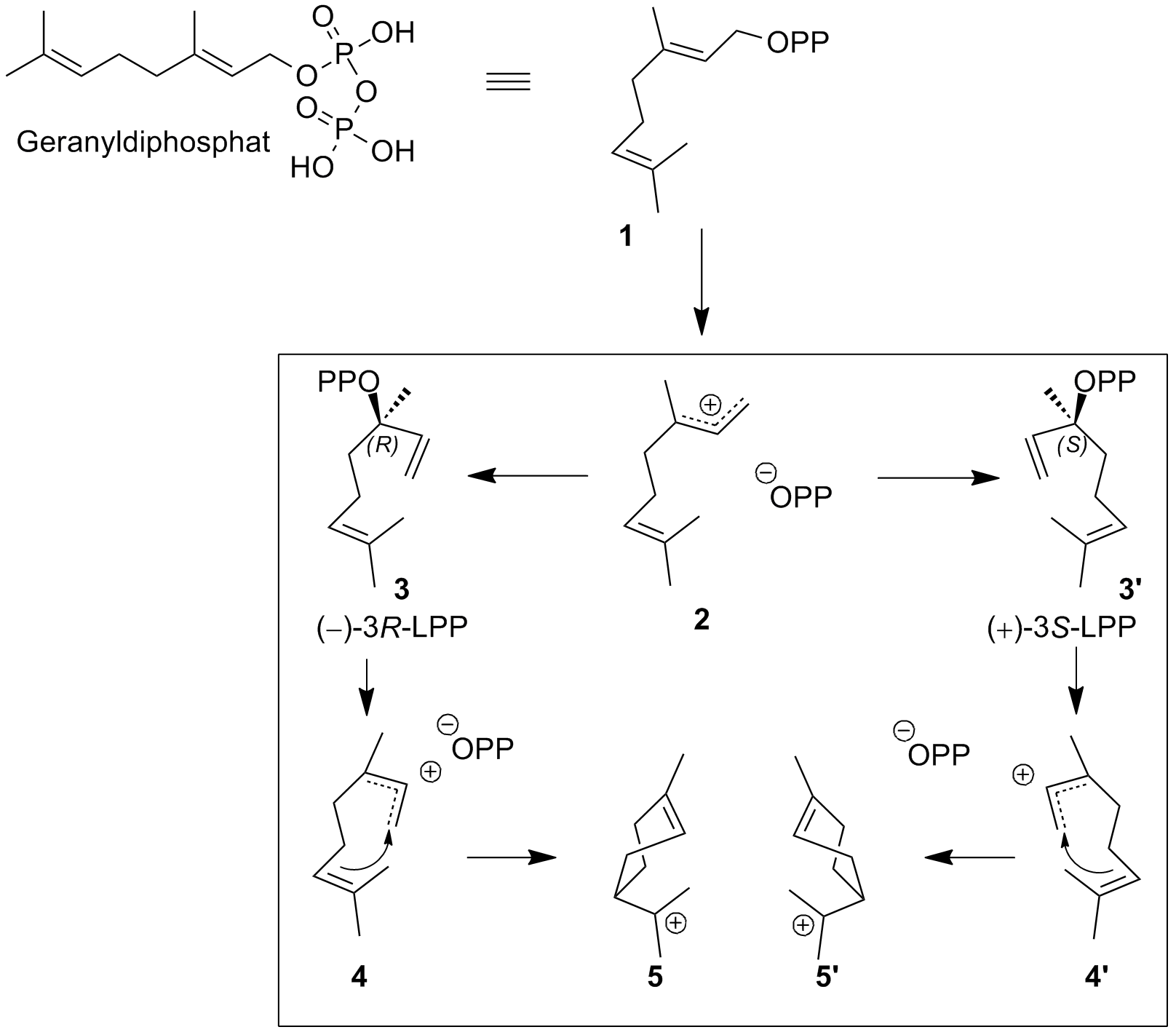
Wie üblich bei Terpenen werden die Pinene durch eine Cyclisierung des Geranyldiphosphat in der Natur dargestellt. Gernayldiphosphat selbst wird aus zwei Isopreneinheiten enzymatisch hergestellt.
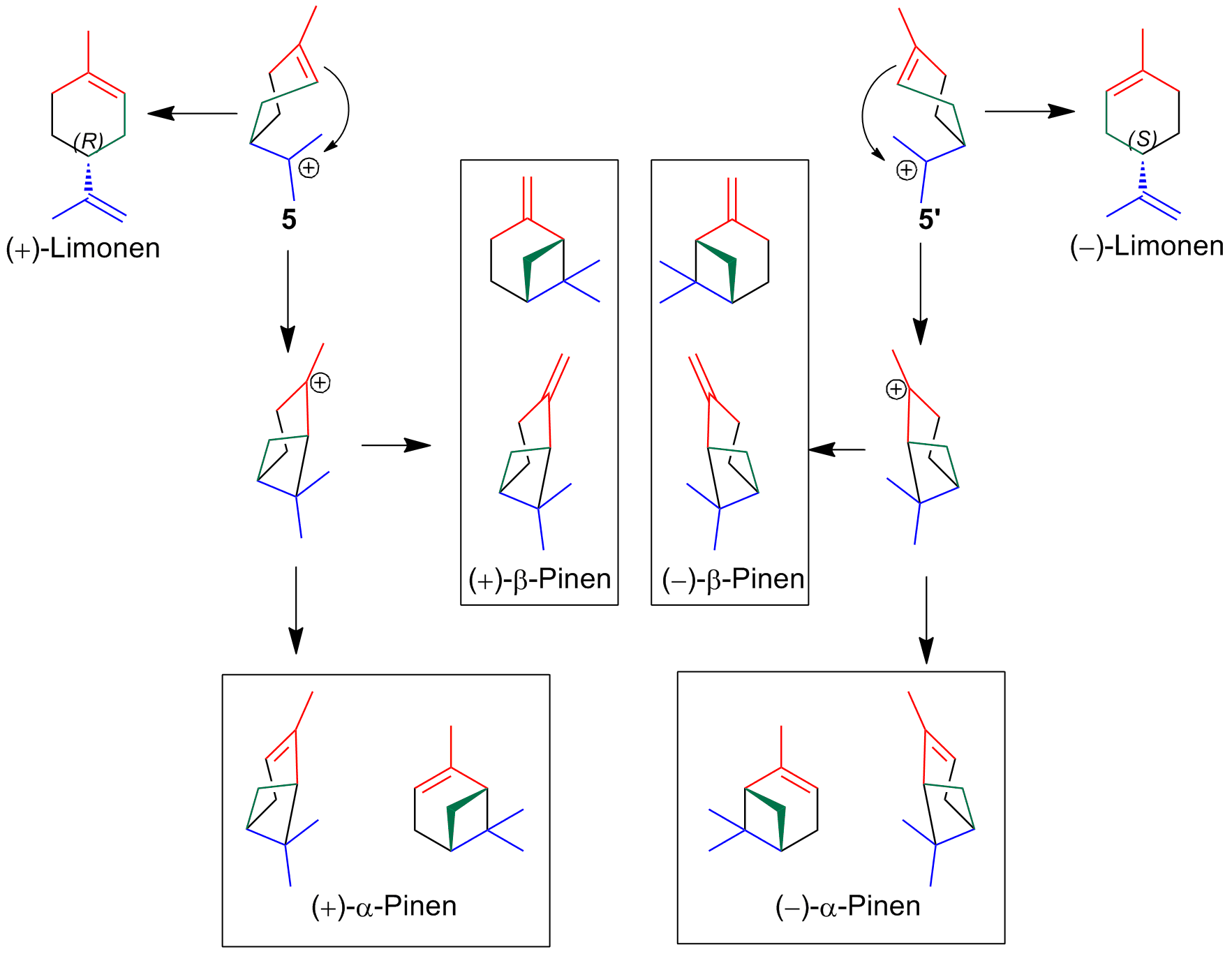
Durch eine erste Umlagerung entsteht direkt im ersten Schritt die entscheidende Konformation zur Entstehung von entweder den (-) oder den (+)-Pinenen. 3 oder 3' cyclisieren dann zu den zentralen Vorgängern der Pinene 5 bzw. 5'.
5 und 5' sind selbst bekannte Terpenen nämlich (+) und (-)-Limonen. Dadurch kann auch einfach erklärt werden, warum neben Pinen im Terpentinöl auch Limonen gefunden wird, da es ein Zwischenprodukt in der Biosynthese von Pinen darstellt.
Das intermediär gebildete Limonenkation 5 bzw. 5' cyclisiert dann erneut zu einem weiteren instabilen Kation. Dieses wird dann schlussendlich durch eine Eliminierung des Protons zum α oder β-Pinen umgewandelt. Es ist zu beachten, dass das Verhältnis zwischen α und β-Pinen in diesem letzten Schritt festgelegt wird, während das Verhältnis der (+) zu den (-) Pinenen direkt im ersten Cyclisierungschritt geschieht.
Diese enzymatische Synthese von α und β Pinen sowie von Limonen wird durch die Pinencyclase I und Pinencyclase II katalysiert. Dabei stellt die Arbeitsgruppe um Croteau fest, dass durch die Pinencyclase I hauptsächlich (+)-α-Pinen, (+)-Limonen und (+)-Camphen gebildet wird, während die Pinencyclase II zu den Terpenen (-)-α-Pinen, (-)-β-Pinen, (-)-Limonen und (-)-Camphen sowie dem offenkettigen Mycren führt.1)